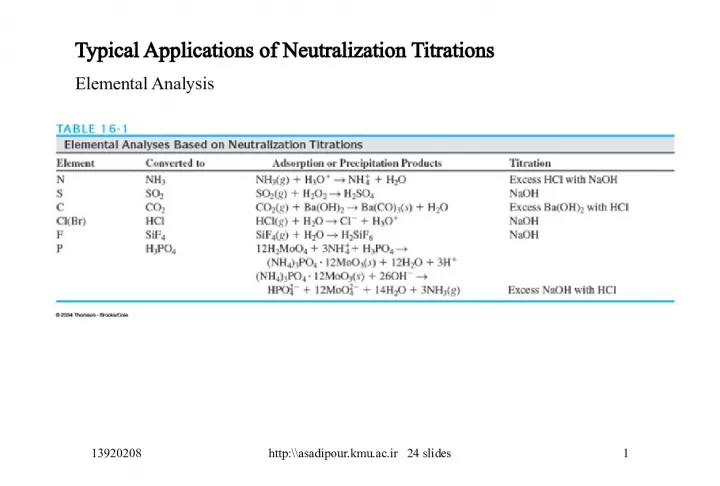
Typical Applications of Neutralization Titrations for Elemental Analysis

This presentation consists of three sections, providing an overview of the typical applications of neutralization titrations for elemental analysis. The first section covers the Keldahl Nitrogen
- Uploaded on | 4 Views
-
 dylanfrench
dylanfrench
About Typical Applications of Neutralization Titrations for Elemental Analysis
PowerPoint presentation about 'Typical Applications of Neutralization Titrations for Elemental Analysis'. This presentation describes the topic on This presentation consists of three sections, providing an overview of the typical applications of neutralization titrations for elemental analysis. The first section covers the Keldahl Nitrogen. The key topics included in this slideshow are . Download this presentation absolutely free.
Presentation Transcript
Slide1Typical Applications of Neutralization TitrationsElemental Analysis 13920208 1 http:\\asadipour.kmu.ac.ir 24 slides
Slide2Keldahl Nitrogen Analysis1)With HCl 2)With H 3 BO 3 13920208 2 http:\\asadipour.kmu.ac.ir 24 slides
Slide3Apparatus used in KjeldahlI . Digestion apparatus II. Distillation & absorption apparatus (I) (II) 13920208 3 http:\\asadipour.kmu.ac.ir 24 slides
Slide413920208 Keldahl Nitrogen Analysis (1) Step 1: Kjeldahl digestion (decomposing and dissolving) Step 2: Neutralization by adding base Step 3: Distillation NH 3 into excess HCl standard Step 4: Titrating unreacted HCl with NaOH standard http:\\asadipour.kmu.ac.ir 24 slides
Slide513920208TMHsiung@2007 5/42 Example: A typical meat protein contains 16.2% (w/w) nitrogen . A 0.500 mL aliquot of protein solution was digested, and the liberated NH 3 was distilled into 10.00 mL of 0.02140 M HCl . The unreacted HCl required 3.26 mL of 0.0198 M NaOH for complete titration. Find the concentration of protein ( mg protein/ml ) in the original sample. Solution: http:\\asadipour.kmu.ac.ir 24 slides
Slide6催化剂煮沸 1. Digestion NCOC + H 2 SO 4 ( NH 4 ) 2 SO 4 + CO 2 + SO 2 + H 2 O 2. Neutralization &distillation 2NaOH + ( NH 4 ) 2 SO 4 2NH 3 ↑+Na 2 SO 4 + 2H 2 O 3. Absorption by boric acid : 2NH 3 + 4H 3 BO 3 ( NH 4 ) 2 B 4 O 7 + 5H 2 O 4. Titration by strong acid ( NH 4 ) 2 B 4 O 7 + 5H 2 O + 2HCl 2NH 4 Cl + 4H 3 BO 3 ( * NCOC, N containing organic compounds , N:HCl = 1:1) Keldahl Nitrogen Analysis (2) 13920208 6 http:\\asadipour.kmu.ac.ir 24 slides
Slide713920208TMHsiung@2007 7/42 Example: A typical meat protein contains 16.2% (w/w) nitrogen . A 0.500 mL aliquot of protein solution was digested, and the liberated NH 3 was distilled into 100.00 mL of 0.0200 M H 3 BO 3 . The mixture required 3.26 mL of 0.0198 M HCl for complete titration. Find the concentration of protein ( mg protein/ml ) in the original sample. Solution: http:\\asadipour.kmu.ac.ir 24 slides
Slide8The Determination of Inorganic SubstancesAmmonium Salts are conveniently determined by conversion to ammonia with strong base followed by distillation. Ammonia is collected and titrated as in the Kjedahl method. Nitrates and Nitrites ions are first reduced to ammonium ion by Devarda’s alloy (50% Cu, 45% Al, 5% Zn) or Arnd’s alloy (60% Cu, 40% Mg). Granules of the alloy are introduced into strongly alkaline solution of the sample in Kjedahl flask. The ammonia is distilled after reaction is complete. 13920208 8 http:\\asadipour.kmu.ac.ir 24 slides
Slide99CO 2 & CO 3 2- chemistry 13920208 http:\\asadipour.kmu.ac.ir 24 slides pK a1 =6.38 pK a2 =10.33
Slide1010CO 2 & CO 3 2- chemistry 13920208 • Na 2 CO 3 →2Na + + CO 3 2- • C O 3 2- HCO 3 - H2CO3 pK b2 =7.62 pK b1 =3.64 http:\\asadipour.kmu.ac.ir 24 slides
Slide1111Phenolphthalein Titration of Na 2 CO 3 with HCl Step 1: Step 2: Na 2 CO 3 + HCl NaHCO 3 + NaCl NaHCO 3 + HCl H 2 CO 3 + NaCl Overall: Na 2 CO 3 + 2HCl H 2 CO 3 + 2NaCl Equivalents of HCl added pH n=1 V e1 n=2 V e2 BCG 13920208 http:\\asadipour.kmu.ac.ir 24 slides
Slide1212Determination of Carbonate in a Sample A 1.2040-g sample containing sodium carbonate and inert material was dissolved in water and titrated to the bromcresol green end point, requiring 32.50 mL of 0.1020 M HCl. Calculate the % Na 2 CO 3 in the sample. For the BCG endpoint, the reaction is Na 2 CO 3 + 2HCl H 2 CO 3 + 2NaCl 13920208 http:\\asadipour.kmu.ac.ir 24 slides BCG
Slide1313Effect of CO 2 Absorption on Phenophthalein Endpoint • Reaction of CO 2 with carbonate solutions CO 2 (g) + H 2 O (l) + CO 3 2 (aq) 2HCO 3 (aq) pH of carbonate solutions may be unstable due to exchange of CO 2 with atmosphere. This effect may be avoided by excluding air from the titration system. 13920208 http:\\asadipour.kmu.ac.ir 24 slides
Slide1414Effect of Absorbed CO 2 on Titration of Na 2 CO 3 with HCl CO 2 (g) + H 2 O (l) + CO 3 2 (aq) 2HCO 3 (aq) V e1 V e2 After absorption Before absorption • V e1 decreases • V e2 is not affected • Use V e2 for calculations 13920208 http:\\asadipour.kmu.ac.ir 24 slides
Slide1515Effect of CO 2 Absorption on OH - concentration OH - standard solutions can react with CO 2 13920208 http:\\asadipour.kmu.ac.ir 24 slides In presence of Phenol phetalein------- Carbonate Error In presence of BCG--------no error CO 2 (g) + 2 OH - → CO 3 2 (aq) This effect may be avoided by excluding air from the titration system.
Slide1616Boiling to Enhance Visual Endpoint in Titration of Na 2 CO 3 with HCl Na 2 CO 3 +HCl HCO 3 - NaHCO 3 + H 2 CO 3 NaHCO 3 Boiling removes H 2 CO 3 as gaseous CO 2 H 2 CO 3 (aq) CO2 (g) + H 2 O 13920208 http:\\asadipour.kmu.ac.ir 24 slides HCO 3 - +HCl H 2 CO 3
Slide17Titration curves and indicatortransition ranges for the analysis of mixtures containing : 13920208 17 http:\\asadipour.kmu.ac.ir 24 slides OH - CO 3 2- HCO 3 - OH - CO 3 2- CO 3 2- HCO 3 - Winkler method Mixture of CO 3 2- +OH - 1)Titrate the mixture with H + In presence of BCG OH - ≈ 1H + --CO 3 2- ≈2H + 2)Excess BaCl 2 is added CO 3 2- + Ba 2+ → BaCO 3 --Titrate the mixture with H + Titrant - ≈ OH - 3) Titrant1-titrant2 ≈ CO 3 2-
Slide18Titration curves and indicatortransition ranges for the analysis of mixtures containing : 13920208 18 http:\\asadipour.kmu.ac.ir 24 slides OH - CO 3 2- HCO 3 - OH - CO 3 2- CO 3 2- HCO 3 - Winkler method Mixture of CO 3 2- + HCO 3 - 1)Titrate the mixture with H + In presence of BCG HCO 3 - ≈ 1H + --CO 3 2- ≈2H + 2)Excess BaCl 2 is added CO 3 2- + Ba 2+ → BaCO 3 --Titrate the mixture with H + Titrant - ≈ HCO 3 - 3) Titrant1-titrant2 ≈ CO 3 2-
Slide19Titration curves and indicatortransition ranges for the analysis of mixtures containing : 13920208 19 http:\\asadipour.kmu.ac.ir 24 slides OH - CO 3 2- HCO 3 - OH - CO 3 2- CO 3 2- HCO 3 - Mixture of 2 weak acids Mixture of CO 3 2- + HCO 3 - 1)Titrate the mixture with H + In presence of BCG (A ml) HCO 3 - ≈ 1H + -- CO 3 2- ≈2H + 2)Titrate the mixture with H + In presence of Phenol phetalein (C ml) Titrant ≈ CO 3 2- 3) ( A-2C)=Bml ≈ H CO 3 -
Slide20Carbonate and Carbonate Mixtures13920208 20 http:\\asadipour.kmu.ac.ir 24 slides
Slide21The Determination of Organic functional GroupsCarboxylic acid group Most CA have between 10 – 4 > K a > 10 –6 . CA are not sufficiently soluble in water for direct titration in this medium. the acid can be dissolved in ethanol and titrated with aqueous base. Alternatively, the acid can be dissolved in an excess of standard base followed by back-titration with standard acid. Sulfonic acid group Sulfonic acids are generally strong acids and readily dissolve in water. Their titration with a base is therefore straightforward. 13920208 21 http:\\asadipour.kmu.ac.ir 24 slides
Slide22Amine groupA) titrated in aqueous media . 1) Aliphatic amines generally have K b on the order of 10 –5 and can thus be titrated directly with a solution of a strong acid. 2) Many saturated cyclic amines , such as piperidine, tend to resemble aliphatic amines in their acid-base behavior and thus can be titrated in aqueous media . B) titrated in non-aqueous solvents Many amines that are too weak to be titrated as bases in water are readily titrated in non-aqueous solvents , such as anhydrous acetic acid, which enhance their basicity. 3) aromatic amines such as aniline and its derivatives are usually too weak for titration in aqueous medium (K b 10 –10 ). 4) The same is true for cyclic amines , such as pyridine and its derivatives. 13920208 22 http:\\asadipour.kmu.ac.ir 24 slides
Slide23Ester groupsEsters are commonly determined by saponification with a measured quantity of standard base: R 1 COOR 2 + OH – R 1 COO – + HO R 2 The excess base is then titrated with standard acid. Hydroxyl groups Hydroxyl groups in organic compounds can be determined by esterification with various carboxylic acid anhydrides or chlorides ; the two most common reagents are acetic anhydride and phthalic anhydride. (CH 3 CO) 2 O + ROH CH 3 COOR + CH 3 COOH The acetylation is ordinarily carried out by mixing the sample with a carefully measured volume of acetic anhydride in pyridine. After heating, water is added to hydrolyze the unreacted anhydride : (CH 3 CO) 2 O + H 2 O 2 CH 3 COOH The acetic acid is then titrated with a standard solution of alcoholic sodium or potassium hydroxide. A blank is carried through the analysis to establish the original amount of anhydride. 13920208 23 http:\\asadipour.kmu.ac.ir 24 slides
Slide24Carbonyl groupsMany aldehydes and ketones can be determined with a solution of hydroxylamine hydrochloride . The reaction, which produces an oxime , is R 1 R 1 C=O + NH 2 OH HCl C=NOH + HCl + H 2 O R 2 R 2 where may be an atom of hydrogen. The liberated HCl is titrated with base. Here, the conditions necessary for quantitative reaction vary. Typically, 30 min suffices for aldhydes. Many ketones require refluxing with the reagents for 1 hr or more. 13920208 24 http:\\asadipour.kmu.ac.ir 24 slides