Electron Configurations


Electron configuration refers to the method of communicating the location and number of electrons present in the electron energy levels, such as 3p5. This notation contains information about the principal quantum number (3), the orbital
- Uploaded on | 4 Views
-
 sarahmayer
sarahmayer
About Electron Configurations
PowerPoint presentation about 'Electron Configurations'. This presentation describes the topic on Electron configuration refers to the method of communicating the location and number of electrons present in the electron energy levels, such as 3p5. This notation contains information about the principal quantum number (3), the orbital. The key topics included in this slideshow are . Download this presentation absolutely free.
Presentation Transcript
Slide1ELECTRON CONFIGURATIONS
Slide2Electron Configuration:A method for communicating the location and number of electrons in the electron energy levels. 3p 5 Principal Quantum Number = 3 Orbital = p Number of electron(s) in the orbital(s) = 5
Slide3•The arrangement of electrons follows the Aufbau Principle. (means building-up in German) in the ground state, the electrons will fill the atomic orbital of lowest energy. • An electron configuration is a listing of the number and kinds of electrons in order of increasing energy , written in a single line. • Example: Li 1s 2 2s 1 • The order, from left to right, is the order of increasing energy of the orbitals
Slide4Aufbau Diagram:
Slide6The order is: 1s, 2s, 2p, 3s, 3p, 4s, 3d,4p, 5s, 4d etc.
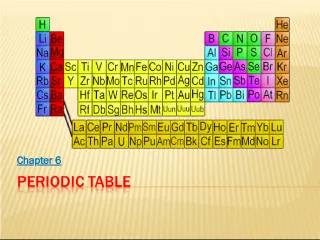
Slide7Procedure for Writing and ElectronConfiguration: • Step 1: Determine the position of the element in the periodic table and the total number of electrons in the atom or simple ion. • Step 2: Start assigning electrons in increasing order of main energy levels and sublevels. • Step 3: Continue assigning electrons by filling each sublevel before going on to the next sublevel, until all the electrons are assigned.
Slide8Element Electron configuration 1 H 1s 1 2 He 1s 2 3 Li 1s 2 2s 1 5 B 1s 2 2s 2 2p 1 7 N 1s 2 2s 2 2p 3 13 Al 1s 2 2s 2 2p 6 3s 2 3p 1 17 Cl 1s 2 2s 2 2p 6 3s 2 3p 5 21 Sc 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 23 V 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3
Slide9EXCEPTIONS:Chromium (24 electrons) EC = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 4 is INCORRECT EC = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 is CORRECT! The d-orbital becomes half-filled so, it changes to 4s 1 3d 5 instead. The next element, Manganese will have an EC of: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5
Slide10This exception also appears near the end ofthe d-orbital filling: Copper EC = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 is INCORRECT EC = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 is CORRECT Additional exceptions are Mo 5s 1 4d 5 ; Ag 5s 1 4d 10 ; Au 6s 1 5d 10 That is reasonable considering their position on the periodic chart.
Slide11Expanded and CondensedElectron Configurations What you had just learned is the expanded notation of writing EC. Example: Na: 1s 2 2s 2 2p 6 3s 1 Expanded form Na: [Ne] 3s 1 Condensed form The “ [Ne] ” is called a kernel = [ closest noble gas ] ONLY NOBLE GASES CAN BE USED AS THE KERNEL
Slide12ORBITAL-BOX DIAGRAMSSimilar to EC, except, you are now expected to draw out the orbitals and place the electrons to show proper spinning . Rules for drawing orbital-Box diagrams 1) The Pauli Exclusion Principle - each orbital can hold 2e-, where those 2e- are always in opposite spin. 2) Hund's Rule – Electrons occupy all the orbitals of a given sublevel singly before pairing begins. Spins of electrons in different incomplete orbitals are parallel in the ground state.The most stable arrangement of electrons in the subshells is the one with the greatest number of parallel spins.
Slide13Suppose we want to draw theorbital-box diagram of carbon : Step 1: Draw the orbitals. Step 2: Fill the electrons in the 1 st two s- orbitals, showing opposite spin. These electrons must fill the lower energy orbitals first before advancing to the next higher energy level (AUFBAU’s PRINCIPLE). Step 3: Fill the 2p sublevels one at a time (HUND’s RULE).
Slide14Orbital DiagramsExamples
Slide151s2s 2p
Slide18IONSVALENCE ELECTRONS The electrons in the outermost shell of the Bohr diagram. Lose electrons = become positively charged (Cation) Gain electrons = becomes negatively charged (Anion)
Slide19ELECTRON CONFIGURATIONS OFIONS Electrons do not come out the same way as we put them in according to the Aufbau Principle. Electrons leave the outer most shell first. Let's look at V vs V 2+ 23 V 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 23 V 2+ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3