Problems on Molality and Concentration


This collection of problems involves various calculations related to molality and concentration. The first problem requires finding the molality when 7.85 kg of KCl is dissolved in 2.38
- Uploaded on | 0 Views
-
 oliverchen
oliverchen
About Problems on Molality and Concentration
PowerPoint presentation about 'Problems on Molality and Concentration'. This presentation describes the topic on This collection of problems involves various calculations related to molality and concentration. The first problem requires finding the molality when 7.85 kg of KCl is dissolved in 2.38. The key topics included in this slideshow are . Download this presentation absolutely free.
Presentation Transcript
Slide17.85 kg KCl are dissolved in 2.38 L of solution.Find molality. 24.8 g table sugar (i.e., sucrose, C 12 H 22 O 11 ) are mixed into 450 g water. Find molality. WRONG
Slide21 mol CaF2 2 atoms F 18 g 6.02 x 10 23 molecules 1 g 1000 mL What mass of CaF 2 must be added to 1,000 L of water so that fluoride atoms are present at a conc. of 1.5 ppm? = 3.34 x 10 28 m’cules H 2 O X m’cule H 2 O = 1000 L 1 L 1 mL 1 mol 6.02 x10 23 m’cule 1 mol 1.5 atom F X atoms F 1,000,000 m’cule H 2 O 3.34 x 10 28 m’cule H 2 O = 1 molecule CaF 2 X = 5.01 x 10 22 atoms F times = 2.505 x 10 22 molecules CaF 2 1 mol CaF 2 X g CaF 2 = 2.505 x 10 22 molecules = 3.25 g CaF 2 78.1 g CaF 2
Slide340.0 g NaOH1 mol NaOH How many moles solute are required to make 1.35 L of 2.50 M solution? mol = M L B. What mass magnesium phosphate is this? A. What mass sodium hydroxide is this? mol L M 3.38 mol = 2.50 M (1.35 L) = X g NaOH = 3.38 mol NaOH = 135 g NaOH 262.9 g Mg 3 (PO 4 ) 2 1 mol Mg 3 (PO 4 ) 2 X g Mg 3 (PO 4 ) 2 = 3.38 mol Mg 3 (PO 4 ) 2 = 889 g Mg 3 (PO 4 ) 2
Slide40.342 mol5.65 L Find molarity if 58.6 g barium hydroxide are in 5.65 L solution. 171.3 g Ba(OH) 2 1 mol Ba(OH) 2 Step 2). What is the molarity of a 5.65 L solution containing 0.342 mol solute? Step 1). How many moles barium hydroxide is this? 0.061 M Ba(OH) 2 = X mol Ba(OH) 2 = 58.6 g Ba(OH) 2 = 0.342 mol Ba(OH) 2 M = mol L M =
Slide5You have 10.8 g potassium nitrate.How many mL of solution will make this a 0.14 M solution? convert to mL
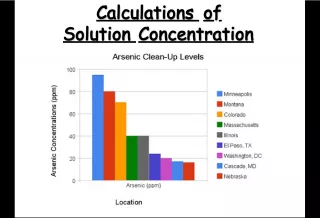
Slide6ConcentrationConcentration SAWS Water Quality Report - June 2000
Slide7MolalityMolality mass of solvent only 1 kg water = 1 L water
Slide8MolalityMolality Find the molality of a solution containing 75 g of MgCl 2 in 250 mL of water. 75 g MgCl 2 1 mol MgCl 2 95.21 g MgCl 2 = 3.2 m MgCl 2 0.25 kg water
Slide9MolalityMolality How many grams of NaCl are req’d to make a 1.54 m solution using 0.500 kg of water? 0.500 kg water 1.54 mol NaCl 1 kg water = 45.0 g NaCl 58.44 g NaCl 1 mol NaCl
Slide10Molarity of SolutionsKeys Keys Molarity of Solutions Molarity of Solutions http://www.unit5.org/chemistry/Solutions.html